western blot原理及步骤
发布日期:2012-10-29 浏览次数:10622
western blot原理及步骤
Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。Western blot技术结合了凝胶电泳的高分辨率和固相免疫测定的特异敏感等多种特点,可检测到低至1~5ng(最低可到10-100pg)中等大小的靶蛋白,广泛应用于检测蛋白水平的表达。
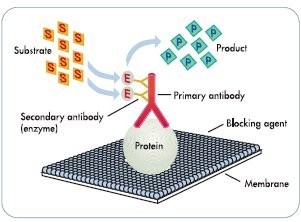 |
| Western Blot原理图 |

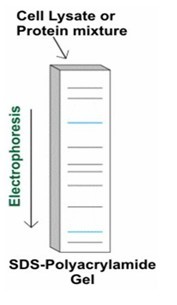
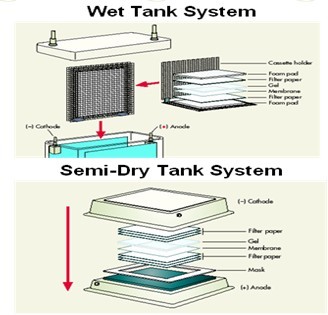
Western Blot实验步骤图
- 1.样品制备:
- 根据样本不同,分为组织处理法、细胞处理法和分泌蛋白的提取。 注意:一般上样20~30 μg已足够,如待检蛋白为低丰度蛋白,可加大上样量至100μg,但电泳条带易拖尾,可制备亚细胞组份或采用更敏感的检测方法。
- 2.电泳分离(参照SDS-PAGE电泳方法):
- 蛋白电泳分离常用SDS-PAGE电泳方法。SDS是一种阴离子去污剂、变性剂,氨基酸侧链与SDS充分结合形成带负电荷的蛋白质-SDS胶束。蛋白质-SDS胶束所带的负电荷大大超过了蛋白质分子原有的电荷量,消除了不同分子之间原有的电荷差异,与强还原剂一起使蛋白分子氢键、疏水键打开,使蛋白质分子线性化。
- 凝胶浓度与所分离蛋白大小的关系如下表
凝胶浓度(%) 线性分离范围(KD) 15 12-43 10 16-68 7.5 36-94 5.0 57-212 - A.做胶前的准备
- (1)检查是否有足够的、干净的 spacer、comb 和架子。
- (2)检查是否有新鲜的,足量10%APS,没有立刻重配。
- (3)按将要检测的抗体对应的原始抗原的分子量大小,计算出胶的浓度,并算出分离胶各组分的用量。
- B.制胶,电泳
- (1)装好架子。
- (2)配制分离胶,在胶上面加入一层蒸馏水,促进胶更好地凝集。
- (3)待分离胶凝集后,配制浓缩胶,倒好后插入预先准备好的梳子。
- (4) 待胶凝集好后,上样,电泳。 上层胶用60-80V电压,当样品至分离胶时,用100-120V电压。一般电泳时间在1.5小时左右。
- 3.转膜
- 蛋白质常用的转移方法主要有两种:槽式湿转和半干转移。前者操作容易,转移效率高;而后者适用于大胶的蛋白转移,所用缓冲液少。以下为槽式湿转的操作步骤。
- (1)将胶浸于转移缓冲液中平衡10min。注意:如检测小分子蛋白,可省略此步,因小分子蛋白容易扩散出胶。
- (2) 依据胶的大小剪取膜和滤纸6片,放入转移缓冲液中平衡10min。如用PVDF膜需用纯甲醇浸泡饱和3-5秒钟。
- (3)装配转移三明治:海绵3层-滤纸-胶-膜-3层滤纸-海绵,每层放好后,用试管赶去气泡。切记:胶放于负极面(黑色面)。
- (4)将转移槽置于冰浴中,放入三明治(黑色面对黑色面),加转移缓冲液,插上电极,100V,1h(电流约为 0.3A)。注意:应再次检查三明治和电极是否装配正确,电源是否接通。
- (5)转膜结束后,切断电源,取出杂交膜。
- 4.封闭、抗体孵育与洗涤
- 蛋白质常用的转移方法主要有两种:槽式湿转和半干转移。前者操作容易,转移效率高;而后者适用于大胶的蛋白转移,所用缓冲液少。以下为槽式湿转的操作步骤。
- (1)用25 ml TBS 洗膜5min,室温,摇动。
- (2)置膜于25 ml 封闭缓冲液中1h, 室温,摇动。
- (3)15ml TBS/T洗3次(5 min/T)。
- (4)加入合适稀释度的一抗,室温孵育1-2h或 4°C过夜,缓慢摇动。
- (5)15 ml TBS/T洗3次(5 min/T)。
- (6)加入合适稀释度的碱性磷酸酶(AP)或辣根过氧化酶(HRP)标记的二抗,室温孵育1h,缓慢摇动。
- (7)15 ml TBS/T洗3次(5 min/T)。
- (8)15 ml TBS洗1次。
- 注意事项:
- 1.操作中戴手套,不要用手触膜。
- 2.PVDF膜在甲醇中浸泡时间不要超过5秒。
- 3.如检测小于20kD的蛋白应用0.2μm的膜,并可省略转移时的平衡步骤。
- 4.某些抗原和抗体可被Tween-20 洗脱,此时可用1.0% BSA代替Tween-20。
- 5.关于封闭剂的选择:5%脱脂奶/TBS or PBS: 能和某些抗原相互作用,掩盖抗体结合能力;0.3~3% BSA in PBS:低的内源性交叉反应性。
- 6.如用0. 1% Tween 20、0.02% NaN3 in PBS or TBS作封闭剂和抗体稀释液,抗体检测后可进行蛋白染色。
- 如要同时检测大分子量和小分子蛋白,最好用梯度胶分离蛋白。
- 5.检测
- (1)二抗与底物反应显色的方法主要有以下两种:
- • 化学发光(Chemiluminescent):灵敏度高,已经达到pg级别,甚至还有Femto级别;
- • 底物显色:包括辣根过氧化物酶HRP、碱性磷酸酶AP、葡萄糖氧化酶等。
- (2)二抗荧光标记法
- 1、 丙烯酰胺和N,N’-亚甲双丙烯酰胺:应以温热(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O至100ml。)储于棕色瓶,4℃避光保存。严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。使用期不得超过两个月,隔几个月须重新配制。如有沉淀,可以过滤。
- 2、 十二烷基硫酸钠SDS溶液:10%(w/v)0.1gSDS,1mlH2O去离子水配制,室温保存。
- 3、 分离胶缓冲液:1.5mmol/LTris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积。过滤后4℃保存。
- 4、 浓缩胶缓冲液:0.5mmol/LTris-HCL(pH6.8):6.05gTris溶于40mlH2O中,用约48ml 1mol/L HCL调至pH6.8加水稀释到100ml终体积。过滤后4℃保存。这两种缓冲液必须使用Tris碱制备,再用HCL调节PH值,而不用Tris.CL。
- 5、 TEMED原溶液:N,N,N’N’四甲基乙二胺催化过硫酸铵形成自由基而加速两种丙稀酰胺的聚合。PH太低时,聚合反应受到抑制。10%(w/v)过硫酸胺溶液。提供两种丙稀酰胺聚合所必须的自由基。去离子水配制数ml,临用前配制。
- 6、 SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris缓冲液8ml,甘油6.4ml,10%SDS 12.8ml,巯基乙醇3.2ml,0.05%溴酚蓝1.6ml,H2O 32ml混匀备用。按1:1或1:2比例与蛋白质样品混合,在沸水终煮3min混匀后再上样,一般为20-25ul,总蛋白量100μg。
- 7、 Tris-甘氨酸电泳缓冲液:30.3gTris,188g甘氨酸,10gSDS,用蒸馏水溶解至1000ml,得0.25mol/L Tris-1.92mol/L甘氨酸电极缓冲液。临用前稀释10倍。
- 8、 转移缓冲液:配制1L转移缓冲液,需称取2.9g甘氨酸、5.8gTris碱、0.37g SDS,并加入200ml甲醇,加水至总量1L。
- 9、 丽春红染液储存液:丽春红S 2g 三氯乙酸30g 磺基水杨酸 30g 加水至100ml 用时上述储存液稀释10倍即成丽春红S使用液。使用后应予以废弃。
- 10、 脱脂奶粉5%(w/v)。
- 11、 NaN3 0.02% 叠氮钠(有毒,戴手套操作),溶于磷酸缓冲盐溶液(PBS)。
- 12、 Tris缓冲盐溶液(TBS):20mmol/LTris/HCL(pH7.5),500mmol/LnaCl。
- 13、 Tween20
- 14、 NBT(溶于70%二甲基甲酰胺,75mg/ml)。
- 15、 BCIP(溶于100%二甲基甲酰胺,50mg/ml)。
- 16、 100mmol/LTris-HCL(pH9.5)。
- 17、 100mmol/L NaCl。
- 18、 50mmol/LTris-HCL(pH7.5),5mmol/L EDTA。
- 分离胶 (单位:ml,Total: 8ml)
7.5% 10% 15% 2×Sep. buffer 4 4 4 30% Gel.sol 2.0 2.7 4 ddH2O 1.9 1.2 0 TEMED 8ul 8ul 8ul 10%APS 80ul 0ul 80ul - 浓缩胶(单位:ml,Total: 3.5ml)
3% 2×Stacking. buffer 1.7 30% Gel.sol 0.35 30% Gel.sol 2.0 ddH2O 1.4 TEMED 5ul 10%APS 50ul
【上一篇】没有了
【下一篇】BD PMG协助发现调控T细胞分化增殖的关键因素


